Über Die Kupferelektrolyse , unterrichtsmaterialien-chemie.uni-goettingen.de
Di: Ava
Kupfer und Recycling Die Wiederverwertung von Kupfer kann als größte und nachhaltigste Kupfer-mine der Welt betrachtet werden. Dabei beginnt die Verwendung von altem, nicht mehr gebrauchtem Kupfer nicht erst mit dem Aufkommen des modernen Recyclinggedankens Ende des 20. Jahrhunderts, sondern zieht sich als roter Faden durch die über 7.000 Jahre Wie ist der Aufbau und die Funktion einer Elektrolysezelle? Hier einfach erklärt! Beispiel: Elektrolyse von Zinkiodid berechnet (mit Formeln)
unterrichtsmaterialien-chemie.uni-goettingen.de
Entscheidend für die Bewertung der Produktion von Metallen aus Rücklaufmaterialien und Schrotten ist neben der Energieeinsparung die beim Recycling zu erreichende Qualität. Wird diese nicht erreicht, dann sind die Vorteile hinsichtlich Energieeinsparungen fragwürdig, da der Energiebedarf ungleicher Materialien verglichen wird. So ist es zum Beispiel im Gegensatz zu 2.1 Raffination von Kupfer Für die Herstellung von Kupfer für die Technik stehen verschiedene Rohstoffe zur Verfügung. An erster Stelle ist das sogenannte Blister kupfer (Blasenkupfer) zu nennen, das – ausgehend vom Erz – im Konverter erschmolzen wird und infolge seines Gasgehaltes blasig er starrt. Weiterhin wird in geringem Umfang Zementkupfer verwendet und 1 Beschreibung des Themas und zugehörige Lernziele Eine Elektrolyse ist eine chemische Reaktion, bei der chemische Umwandlungen durch elektri-schen Strom erreicht werden. Eine Elektrolysezelle besteht aus einem positiven Pol (Anode) und einem negativen Pol (Kathode). Die Oxidationsvorgänge laufen an der Anode ab, die Reduk-tionsvorgänge finden an der Kathode
Kupferraffination Kupferraffination bezeichnet ein technisches Verfahren zur Herstellung von Kupfer. Produkt-Highlight Wassergehalt präzise bestimmen – Elektrolyse, galvanische Abscheidung, die Zersetzung von Elektrolyten durch Anlegen eines elektrischen Stromes. Elektrolyte sind bis auf wenige Ausnahmen Jede Elektrode hat ein unterschiedliches Redoxpotenzial, das eine Spannung erzeugt, wenn die Elektroden über einen elektrischen Leiter verbunden
Ein Beitrag über die Gewinnung und Herstellung von Aluminium ist in diesem Werkstofftechnik-Skript zu finden. Aluminium wird durch das Bayer-Verfahren und eine sich anschließenden Elektrolyse aus dem Aluminium-Erz Bauxit gewonnen. B. ELEKTROLYSEZELLE (Abb. 2) Chemische Reaktionen werden im Unterschied zur galvanischen Zelle durch Anlegen einer äußeren Spannung erzwungen. Daher verlaufen die Reaktionen an den Elektroden den spontanen galvanischen Reaktionen entgegengesetzt. Die Mindestspannung, die zur Elektrolyse erforderlich ist, ist etwas höher als die Spannung mit
Kupfer (II)-chlorid ist eine chemische Verbindung und ein Kupfer -Salz der Salzsäure mit der Formel CuCl 2. Kristallwasserfreies Kupfer (II)-chlorid ist ein braunes Pulver, welches stark hygroskopisch ist. Durch den Einbau von Wassermolekülen in seine Kristallstruktur entsteht das Kupfer (II)-chlorid-Dihydrat, ein blau-grüner Feststoff mit der Formel CuCl 2 · 2 H 2 O. Das
Über die Ausscheidung von Metall-Legierungen durch Elektrolyse
Elektrolyse und Eloxieren von Aluminium Bei einer Elektrolyse führt die von aussen zugeführte elektrische Energie dazu, dass sich Redox-reaktionen wieder rückgängig machen lassen. Dies bildet die Grundlage für die technische Gewinnung von reinen Metallen wie Natrium, Aluminium, Kupfer und Halogene wie Chlorgas. Auch bei wieder aufladbaren Batterien, den Akkus, findet Die elektrochemische Umwandlung von chemischer in elektrische Energie durch Galvanische Zellen und deren Funktionsweise steht im Mittelpunkt dieser Zusammenfassung. Die Galvanische Zelle Funktion basiert auf Redoxreaktionen zwischen verschiedenen Metallen und ermöglicht die Erzeugung elektrischer Energie. • Die Galvanische Zelle Aufbau besteht aus Kupfer-Rohre an der Universität Bayreuth: Etwa 80% der an der Universität Bayreuth verarbeiteten Rohre bestehen aus Kupfer. Die meisten übrigen Leitungen sind aus Edel-stahl, da die diese kostengünstiger sind. Ein kleiner Anteil besteht zudem aus dem Kunst-stoff PVC, welcher geklebt wird und so einem Druck von bis zu 16 bar stand hält. Diese Kunststoff-Rohre
über nacht wurde das elektrolyt wohl verbraucht zu mindest hatte die bläschen bildung an der kathode aufgehört. die zugabe von weiterem zitronensaft und salz konnte den prozess nur geringfügig reaktivieren. wahrscheinlich war die batterie auch inzwischen alle. kp ob da jetzt wirklich was passsiert ist. ich hab den aufbau dann mal
- Recycling von Kupferwerkstoffen
- Sicherheitsdatenblatt: Kupfer
- Anode und Kathode in der Chemie
- Grundlagen und Experimente aus dem Bereich der Elektrochemie
Vorliegende Arbeit hat nun das Ziel, an der Hand eingehender Untersuchungen -ein klares Bild über die Vorgänge bei der Kupferelektrolyse aus kupferchlorürhaltigen Elektrolyten zu bringen. Teilweise wird zwischen dekorativer und funktionaler Galvanotechnik unterschieden. Erstere dient vorwiegend der Verschönerung von Gegenständen und muss für diesen Zweck gewisse technische Mindesteigenschaften aufweisen. Beispiele für die dekorative Galvanotechnik sind die Kunststoffgalvanisierung, die Verchromung von Stahlrohrmöbeln, Armaturen und Motorrädern
Eine galvanische Zelle, galvanisches Element, Daniellsches Element oder galvanische Kette ist eine Vorrichtung zur spontanen Umwandlung von chemischer in elektrische Energie. Sie wird in Batterien und Akkumulatoren verwendet. Jede Kombination von zwei verschiedenen Elektroden und einem Elektrolyten bezeichnet man als galvanisches Element. Sie dienen als
Kupfer: Vorkommen, Eigenschaften und Gewinnung Die Eigenschaften von Kupfer machen es zu einem der wichtigsten Metalle in der modernen Industrie. Als rötlich schimmerndes Edelmetall zeichnet sich Kupfer durch seine außergewöhnliche Leitfähigkeit und Verarbeitbarkeit aus. Mit einer Kupfer Dichte von 8,96 g/cm³ gehört es zu den Schwermetallen. Das 216 265 265 1 1 Dr. Rudolf Bock Erhard Grallath Wolfgang Dünges Institut für Anorganische Chemie und Kernchemie der Johannes Gutenberg-Universität Mainz Deutschland Chemin de Béranges 141 CH-1814 La Tour de Peilz Schweiz Abstract Irregularities during the electrolytic deposition of copper are caused by varying concentrations of traces of chloride
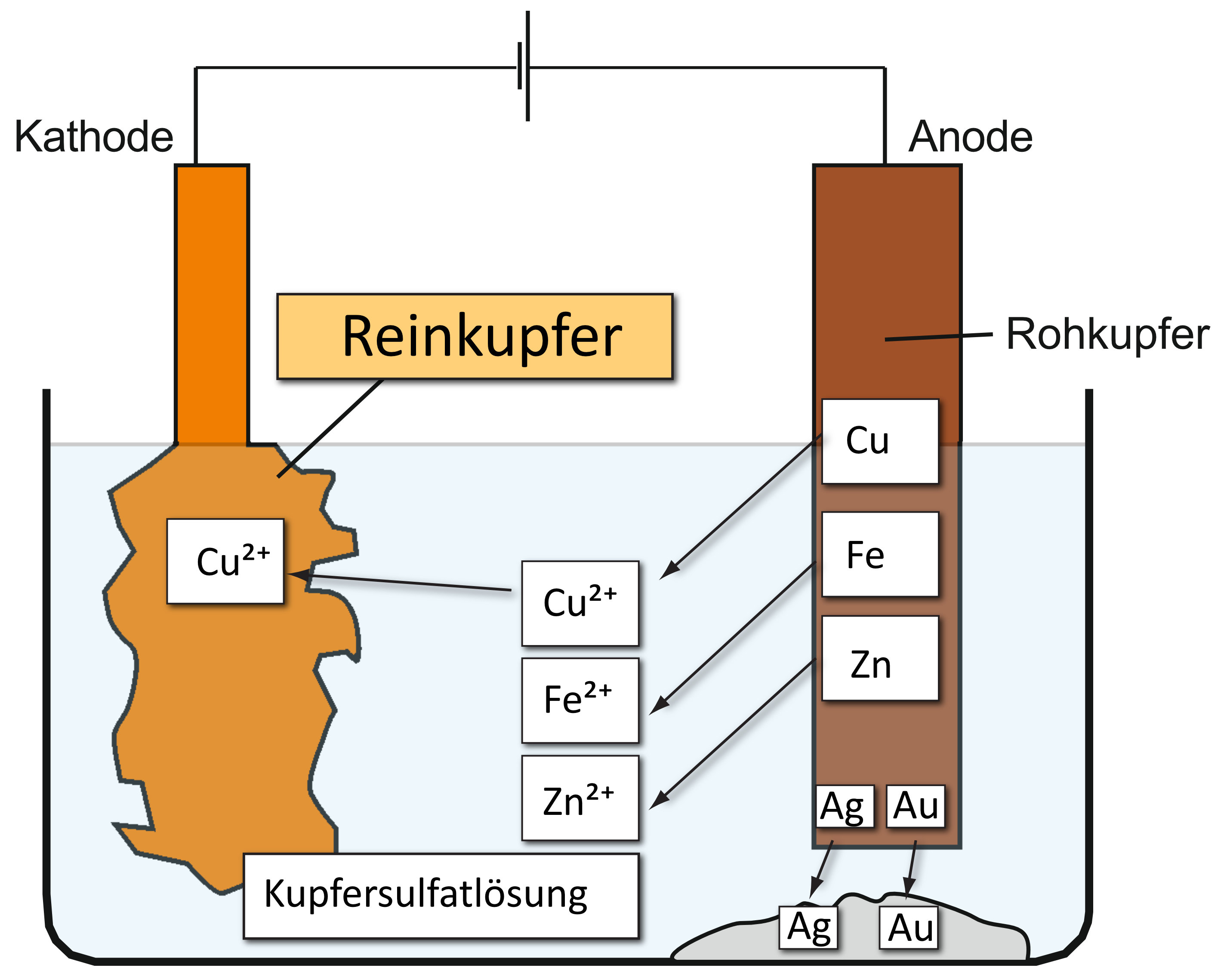
Technische Elektroysen werden zur Produktion von Chemikalien für die Produktion in anderen Bereichen genutzt. Durch die Kombination von mechanischen, pyro‐ und hydrometallurgischen Verfahren, können komplexe Rohstoffe, wie bspw. die Platinen, aufgetrennt werden. Über die elektrolytische Raffination kann aus Rohkupfer elementares Kupfer gewonnen werden. Zusätzlich fällt der aus Edelmetall bestehende Anodenschlamm aus. Anhand von Lokalelementen wird erklärt, dass in bestimmten Systemen Redox-Reaktionen spontan auftreten. Ein Erkenntnisgewinn wird erhalten, wenn im Experiment der Ort der Oxidation von dem der Reduktion räumlich getrennt wird. Speziell im untersuchten Evans-Element kann durch diese räumliche Trennung das Rosten von Eisen quantitativ durch den in
Anode und Kathode in der Chemie
Das elektrochemische Äquivalent mit der Einheit ist ein materialabhängiger Proportionalitätsfaktor des betrachteten Elements. Dazu geht die molare Masse , die Wertigkeit des Elements und die Faradaysche Konstante mit in die Berechnung ein. Wenn du nicht mehr genau weißt, was die molare Masse ist haben wir hier das passende Video für dich.
Das Kupfer wird elektrolytisch auf der gesamten Oberfläche sowie in den Löchern abgeschieden, um die Ebenheit und Verteilung zu verbessern. Bei der elektrolytischen Kupferabscheidung entsteht Elektrolyse, d. h. ein Stromfluss durch eine Flüssigkeit, der chemische Veränderungen bewirkt. Nach mehreren Bädern von jeweils 3 Minuten Dauer wird eine Elektrolyse erzeugt,
Bei der Elektrolyse einer Lösung von Anionen und Kationen werden durch das Anlegen einer Spannung Elektronen von einem Anion auf ein Kation übertragen. Dies geschieht entgegen des Redoxgefälles. Es ist der Umkehrprozess des Galvanischen Elements, bei dem Elektronen mit dem Redoxgefälle und ohne eine äußere Spannung von einem Partner auf den anderen
Gewonnen wird Elektrolytkupfer durch Abbau in Form von Kupfererz. Dieses liegt als Carbonate (Kohlenstoffanteil) und Sulfate (Schwefelanteil) vor. Durch Brechen, Zermahlen und Trennen vom Restgestein werden die kupferhaltigen Bestandteile für die Verhüttung vorbereitet. Im Verhüttungsprozess werden Schwefel-, Kohlenstoff- und Wasseranteile entzogen und zu Legt man verschiedene Metallstäbe in eine Kupfer (II)-sulfat-Lösung, bildet sich auf dem Eisenstab ein Kupferspiegel, während auf dem Silberstab keine Kupferabscheidung stattfindet. Auf allen Metallen, die besser oxidierbar sind als Kupfer, scheidet sich in einer Kupfer (II)-salz-Lösung Kupfer ab. Bei Metallen, die schlechter oxidierbar sind als Kupfer, beispielsweise bei Dabei stellt sich zwischen den Ionen, die in Lösung gehen und der Anzahl der Ionen, die sich an der Elektrode abscheiden und zum Metall reagieren ein Gleichgewicht ein. Je nachdem ob Lösungsdruck oder Abscheidungsdruck stärker sind, herrscht an der Elektrode Elektronenmangel oder Elektronenüberschuss.
4.1 Elektrolyse Elektrolysen sind Vorgänge, bei denen durch den elektrischen Strom stoffliche Veränderungen des Elektrolyten erzwungen werden. Bei der Elektrolyse einer wässrigen Zinkchlorid-Lösung entsteht an der Kathode Zink, und an der Anode entwickelt sich Chlor. Die hydratisierten Ionen werden also jeweils an der entgegengesetzt geladenen Elektrode entladen:
Technische Elektrolysen am Beispiel der Zementation – Einfach erklärt anhand von sofatutor-Videos. Prüfe dein Wissen anschließend mit Arbeitsblättern und Übungen. Einen Prozess, bei dem ein elektrischer Strom eine Redoxreaktion erzwingt, nennt man Elektrolyse. Die Abscheidung von Metallen aus einer Lösung, die die entsprechenden Metallionen enthält, durch einen von außen aufgeprägten Strom ist ebenfalls eine Elektrolyse.
- Überbackene Ofengrillkartoffeln Mit Zwiebeln Und Käse
- Übersetzung Für Ich Bin Geschaft Im Englisch
- Überladen Von Prozeduren Und Operatoren
- Übersetzung Für Zahnarzthelferinnen Im Englisch
- Österreich Will Europäischem Luftverteidigungssystem Beitreten
- Özgecan Aslan Davasının Kararı, Dünyaya Emsal Olsun‘
- Öffnungszeiten „Strick Und Style“
- Übergewicht In Der Ätiologie Der Gonarthrose
- Übergreifende Aufgaben: Bildungsportal Niedersachsen
- Österreich Visum Oslo 2024 _ Zypern Visum Nikosia 2024