Quelle Est La Composition De Fe2 Et Fe3
Di: Ava
On mélange 10mL de solution de chlorure d’étain (II) à 0,1mol/L et 10mL de solution de chlorure de fer (III) également à 0,1mol/L. Quelle est la composition finale du système ? TD/TP 01 L’évolution de l’atmosphère à de très grandes échelles de temps La composition de l’atmosphère joue un rôle non négligeable sur le climat global de la Terre. Actuellement composée à 78% de N2 et 21% de O2, les autres gaz de l’atmosphère jouent un rôle par exemple dans l’effet de serre et même si leur taux est relativement faible comme celui du CO2 (environ Fer propriétés physiques et chimiques: générales données, thermiques propriétés, energie de ionisation, isotopes, potentiels de réduction, abondance de l’élément, données cristallographiques.

Exercice 1 : L’eau oxygénée ( solution aqueuse de péroxyde d’hydrogène H2O2) conduit à la formation de dioxygène lorsqu’on la met en contact avec une blessure. Expliquer en sachant que cette réaction est une réaction d’oxydo-réduction dans laquelle le péroxyde d’hydrogène intervient en tant que oxydant et en tant que réducteur. Sa constante d’équilibre vaut K= 160 à 25 °C. 2. On forme ce complexe en mélangeant une solution de chlo- rure de fer (III), (Fe³+ 3 Cl (aq)) (aq), avec une solution de thiocyanate de potassium (K+ (aq), SCN (aq)). a. Quelle est la valeur du quotient de réaction à l’état initial? b. Quelle est sa valeur à l’état final d
Pourquoi le fer est une réaction de réduction
MX 3 LE FER ET SES COMPOSÉS INTRODUCTION : sont Fe0, Fe2+ et Fe3+. Il existe également au degré d’oxydation +IV, +V et +VI (notamment dans le vivant), mais on ne s’intéressera pas à ces degrés d’oxydation plus particulier Métaux de transition 4ème élément le plus abondant après l’oxygène, le silicium et l’aluminium. Question « Dans les compositions des roches en % d’oxydes, le fer est associé à 2 espèces FeO et Fe2O3. Or dans votre tableau de conversion seule la rubrique FeO apparaît. Doit-on les regrouper pour évaluer la teneur en fer ? »
Document 2 : les différentes formes ioniques du fer Le fer constitue 5% de la masse de la croûte terrestre. En solution aqueuse, le fer existe à l’état naturel Bonjour, La réponse peut paraitre évidente, mais je n’arrive pas à la trouver avec une précision adéquate : l’oxydation des ions Fe2+ en ions Fe3+ par simple action de l’air est-elle assez élevée pour fausser un titrage d’ions fer II ou est-ce négligeable dans un temps raisonnable ? Si oui combien de temps environ ? (Les solutions à titrer son contenue dans des bocaux Le fer est l’un des éléments les plus abondants dans la croûte terrestre, et il se présente sous différentes formes d’oxydation, notamment sous les états ferrique (Fe³⁺) et ferreux (Fe²⁺). Le fer divalent (Fe²⁺) est particulièrement important dans la formation et la
Principe de reconnaissance des ions : Un test de reconnaissance a pour objectif de prouver la présence des ions dans une solution ionique.
- Pourquoi le fer est une réaction de réduction
- Le fer : rôles, quantités et hémochromatose
- Dosage des ions Fe2+ et Fe3+ dans un vin blanc
Le fer est un métal gris portant le numéro atomique 26 et le symbole « Fe ». On le rencontre sous diverses formes de minerais dans la nature.
Obtenez les faits pour l’élément Fer (Fe) [26] depuis le tableau périodique. Trouvez les données physiques, configurations électroniques, propriétés chimiques, les états d’agrégation, isotopes (avec chaînes de désintégration) aussi bien que des informations historiques. C’est le plus important de tous les métaux utilisés, en particulier dans les aciers. Cet échange très minime n affecte pas la composition de la solution et génère un potentiel électrique, appelé potentiel de membrane. Celui-ci est une fonction affine du pH de la solution aqueuse dans laquelle l’électrode est plongée. Everre = a – b.pH On mesure entre l électrode de verre et l ECS une tension U :
L’ion Fe3+ donne un ion complexe thiocyanofer [Fe(SCN)]2+, de couleur rouge vif, en présence de l’ion thiocyanate SCN-. Le dosage se fait par spectrophotométrie : on mesure la quantité de lumière absorbée par la solution colorée (absorbance) et on compare à celle absorbée par des solutions de concentration connue. On utilise pour cela la loi de BEER-LAMBERT :
Réactions de complexation
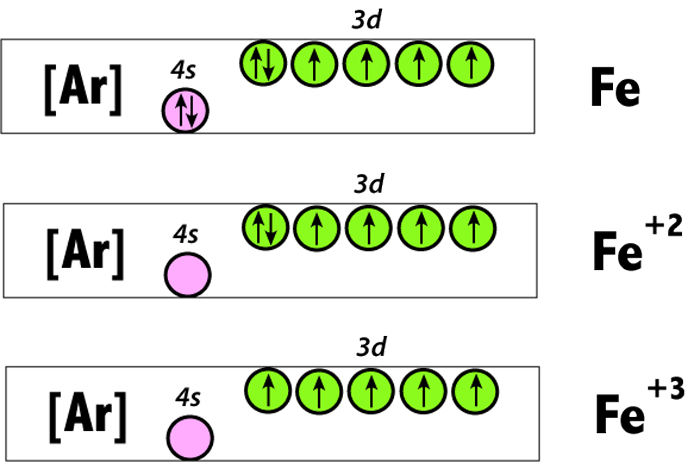
Le fer est un oligoélément dit « essentiel », c’est-à-dire qu’il ne peut pas être synthétisé par l’organisme et doit donc être apporté par l’alimentation. Un excès ou une carence en fer peut donc dérégler de nombreux mécanismes biologiques essentiels au fonctionnement du corps. Video Transcript Compte tenu de la configuration électronique du fer métallique représentée sur la figure, quelle est la configuration électronique de l’ion Fe2+ ? La question porte sur la notion de configuration électronique. Les diagrammes de configuration électronique de cette question représentent les électrons comme des flèches pointant vers le haut ou vers le bas. Les
Il apparait alors un précipité. 1) Donne la composition du sulfate de fer II 2) Quelle est la couleur du précipité ? 3) Lorsqu’on laisse la solution de sulfate de fer II à l’air libre pendant plusieurs jours et qu’on refait le test de la soude, il apparait un précipité rouille. Quel ion est ainsi caractérisé ? # 1 pile Daniell Une pile Daniell est constituée d’une électrode de cuivre plongeant dans une solution de sulfate de cuivre et d’une électrode de zinc plongeant dans une solution de sulfate de zinc. E 0 (Cu 2+ / Cu) = 0,34 V ; E 0 (Zn 2+ / Zn) = 0,34 V ; Quelle est la borne positive de la pile ? Quelle est la fem de la pile si [Cu 2+] = [Zn 2+]=0,1 mol L -1? L’omniprésence du fer influence fortement la composition des sols et des eaux qui entrent en contact avec lui. Qu’il soit dissous ou en suspension, le fer s’accumule généralement dans l’eau par érosion. Mais quels sont les problèmes liés à sa présence et comment l’extraire ?
La solution obtenue contient l’ion ferreux Fe 2+. Ajouter de l‘ eau oxygénée H 2 O 2 . La couleur passe au rouge brique et la solution contient maintenant l’ion ferrique Fe 3+. Ajouter de l‘ ammoniaque NH 3 (aq) ou de l‘ hydroxyde de sodium NaOH . Il se forme un précipité très volumineux d‘ hydroxyde de fer (III) Fe (OH) 3 rouge-brun. Table des potentiels standards Couples rédox, équation rédox et potentiels standards (E°) des couples oxydoréduction. Magnétite La magnétite (Fe3O4) est un minéral oxyde de fer commun. Cest un membre du groupe spinelle. Ce sont des minéraux qui partagent la même structure mais qui diffèrent par leur composition chimique. Les autres membres notables du groupe sont la chromite et le spinelle. La magnétite fait partie des deux principales sources de fer. Lautre minéral
Calculatrice de masse molaire, calcule la masse molaire, le poids moléculaire et la composition élémentaire de tout composé donné. Quelle est la composition du noyau issu de cette désintégration ? I-3) Ecrire l’équation différentielle qui rend compte de la vitesse de disparition d’un échantillon de N atomes de 59 26 Fe . En déduire, par intégration, la dépendance temporelle N(t) du nombre d’atomes.
Il est donc important que l’élément fer de l’hème ne soit pas oxydé et reste sous la forme d’ion Fe 2+. Dans cet exercice, on étudie d’abord l’oxydation des ions ferreux en ions ferriques. Ensuite, une méthode de dosage de l’hémoglobine dans le sang et Données physico-chimiques Données atomiques Numéro atomique Masse atomique Configuration électronique Structures cristallines Rayon métallique pour la coordinence 12 26 55,85 g.mol-1 [Ar] 3d6 4s2 alpha puis gamma entre 912°C et 1394°C et à nouveau alpha. Forme alpha : cubique centrée de paramètre a = 0,286 nm Forme gamma : cubique à faces centrées Il entre dans la composition de l’hémoglobine, jouant un rôle de transporteur d’oxygène vers nos cellules. Il existe sous forme non héminique (ferrique Fe3+) d’origine végétale, et sous forme héminique (ferreux Fe2+) d’origine animale, qui est plus facilement assimilable. Son assimilation est fortement impacté par la vitamine C. Il est donc de bon augure de lier fer et vitamine
La chimie des solutions est une séquence-phare dans le programme de PCSI puis- qu’elle sera régulièrement utilisée dans le cursus des étudiants, notamment en travaux pratiques. On peut alors commencer cette séquence par les réactions d’oxydoréduction puis les réactions acido-basiques car elles sont familières pour les élèves : un certain nombre d’outils ont déjà été
Les deux éléments impliqués, le fer et le chlore, changent chacun d’état d’oxydation ; fer de +2 à +3, chlore de 0 à -1. Il y a alors effectivement deux demi-réactions qui se produisent. Ces changements peuvent être représentés dans des formules en insérant des électrons appropriés dans chaque demi-réaction : Fe2+ → Fe3+ + e. Le fer et ses ions : dosage potentiométrique, chimie concours Mines 08 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. . . Calculatrice de masse molaire, calcule la masse molaire, le poids moléculaire et la composition élémentaire de tout composé donné.
En modifiant l’environnement chimique d’un ion fer (II), une transition entre les deux états électroniques BS et HS est susceptible d’intervenir. Dans la suite du problème, on considère des ions fer (II) complexés par 3 ligands bidentates.. Que signifie „bidentate“ ? Illustrer le propos en prenant comme exemple l’éthylène diamine notée (en). Les ligands bidentates sont des Exprimer la quantité de matière d’électrons ayant circulé dans le circuit en fonction de xf et du volume des demi-piles. Fe3+ (aq) +e- = Fe2+(aq). x f V mol d’ion fer (III) se réduit ; la quantité de matière d’électrons est x f V = xf mol car V=1 L. En déduire
Définition C’est le diagramme qui représente l’équilibre (Métastable) entre Fer pure et la cémentite (Fe3C). Comme tout diagramme d’équilibre, il représente les différentes composition et phases qui résultent de la variation de la concentration du fer ; du fer pur (0%mC) à la cémentite (6,7%mC). Description Le fer pur représente la partie limite gauche et la
Cours 7- Métabolisme du fer Introduction : le fer +ferreux (Fe2 ) son transport son stockage une forme non toxique on : Le fer est un élément indispensable à toute forme de vie et en parti ulier pour le transport de l’oxygène. Il existe sous deux formes, le fer ferreux (Fe2+) et le fer ferrique (Fe3+). L’excès V1=V2=50mL c=0.010mol.L-1 On ajoute n=5.00mmol de fluorure de sodium dans le compartiment 1 de la pile et on mesure une f.e.m E=0.66V. Seul le cation Fe3+ estcomplexé par les ions fluorure et cette réaction de complexation est quantitative. 1. Quelle est la polarité de la pile ainsi réalisée? justifier qualitativement.
- Quelle Temperature Fait-Il Dans Le Desert Du Sahara?
- Quest Multi-Function Steam Cleaner 41990 Upright And Handheld
- Queensland Legislation Handbook
- Quel Est Le Travail D’Un Technicien Paie
- Queen: La Banda Que Se Rehúsa A Morir
- Que Es La Tir Y El Van Resumen
- Querlenker Für Bmw X3 E83 2.0 D 150 Ps Diesel 110 Kw 2004
- Quelles Mesures D’Hygiène Sont Prises Par Les Infirmières
- Quelle Robe De Mariée Choisir Pendant La Grossesse
- Quels Droits Ont Les Agents Douaniers
- Quebec Nach New York Per Flugzeug, Zug, Bus Oder Auto
- Que Significa El 0 En Codigo Binario