Equilíbrio Iônico- Constante De Acidez E Basicidade E Lei Da Diluição
Di: Ava
Equilíbrio Iônico da Água: O estudo do equilíbrio iônico da água oferece a base para a compreensão de como as concentrações dos íons hidrônio (H3O+) e hidroxila (OH-) interagem e se equilibram em solução aquosa, fato importante para a 1) O documento discute conceitos de ácidos, bases e equilíbrio químico em soluções aquosas segundo as teorias de Arrhenius, Brønsted-Lowry e Lewis.

Mergulhe no universo do equilíbrio químico e desvende uma das ferramentas mais poderosas para entender o comportamento de ácidos e bases fracas. Este guia completo sobre a Lei de Diluição de Ostwald irá transformar sua maneira de encarar os cálculos de ionização, com um resumo claro, uma aula detalhada e exercícios resolvidos para solidificar seu Prévia do material em texto o equilíbrio iônico estuda as reações reversíveis que envolvem íons, com suas características específicas, que precisam de fato ser analisadas com maior atenção. Por isso, fez-se esta separação. Constante de ionização Uma das particularidades elementares dessas reações é que se trata de ionizações (no caso de · Os diferentes tipos de equilíbrios iônicos · Grau de Ionização e a força de ácidos e bases · O Equilíbrio iônico em ácidos e bases fracos · A constante de ionização · A Lei da diluição de Ostwald · As Informações fornecidas pela constante Índice 1) Introdução (00.15 ) 2) Apresentação do episódio (00.57 ) 3) O
UERJ 2016 / 2° EQ Questão 33
Constante de acidez e constante de basicidade As reações de ionização de ácidos fracos ou de bases fracas são pouco extensas, sendo tratadas como um equilíbrio químico, pelo que há uma constante para esse equilíbrio. No caso dos ácidos é a constante de acidez, \ (K_ {a}\), e no das bases é a constante de basicidade, \ (K_ {b}\). A constante de ionização ou constante de dissociação pode ser definida como um valor que expressa a relação entre as concentrações dos eletrólitos dissociados em meio aquoso, ou mais precisamente aplicando a lei da ação das massas podemos afirmar que é o equilíbrio iônico em solução aquosa, de acordo com lei da ação das massas é também um equilíbrio químico onde
Prévia do material em texto Equilíbrio Iônico, pH e pOH I) Equilíbrio Iônico Questão 01) Considere o equilíbrio químico que se estabelece em uma solução aquosa de ácido acético que pode ser representado pela equação: CH3COOH(aq) CH3COO -(aq) + H+(aq) Mantendo-se constante a temperatura e adicionando-se uma solução aquosa de acetato de
EQUILÍBRIO QUÍMICOOlá, pessoal! Espero que vocês estejam bem!No vídeo falaremos sobre a constante de acidez (Ka) e basicidade (Kb).Bons estudos =D O que é Equilíbrio Iônico? É o estudo do equilíbrio químico de ácidos e bases em soluções aquosas, além de moléculas não ionizadas. Esta grandeza indica quanto por cento do ácido sofreu ionização, indicando a força do ácido ou da base. Você já
Por fim podemos concluir que a Lei da diluição de Ostwald ou Lei de Ostwald é a relação matemática entre a constante de ionização e o grau de ionização de um electrólito (ácidos, bases). Foi formulada pelo químico alemão Friedrich Wilhelm Ostwald.
1. Conceito Ocorre quando, em uma reação reversível, a velocidade da reação direta é igual à velocidade da reação inversa. Uma vez atingido o estado de equilíbrio, as concentrações de reagentes e produtos permanecem constantes. Consideremos a equação genérica: onde: – v1 é a velocidade da reação direta e v2 a velocidade da reação inversa. No início v1 é o máximo
Estude com atividades resolvidas e amplie seus conhecimentos. Veja nossa lista completa de Exercícios sobre Lei da Diluição de Ostwald.
Conceito de pH e Escala de pH
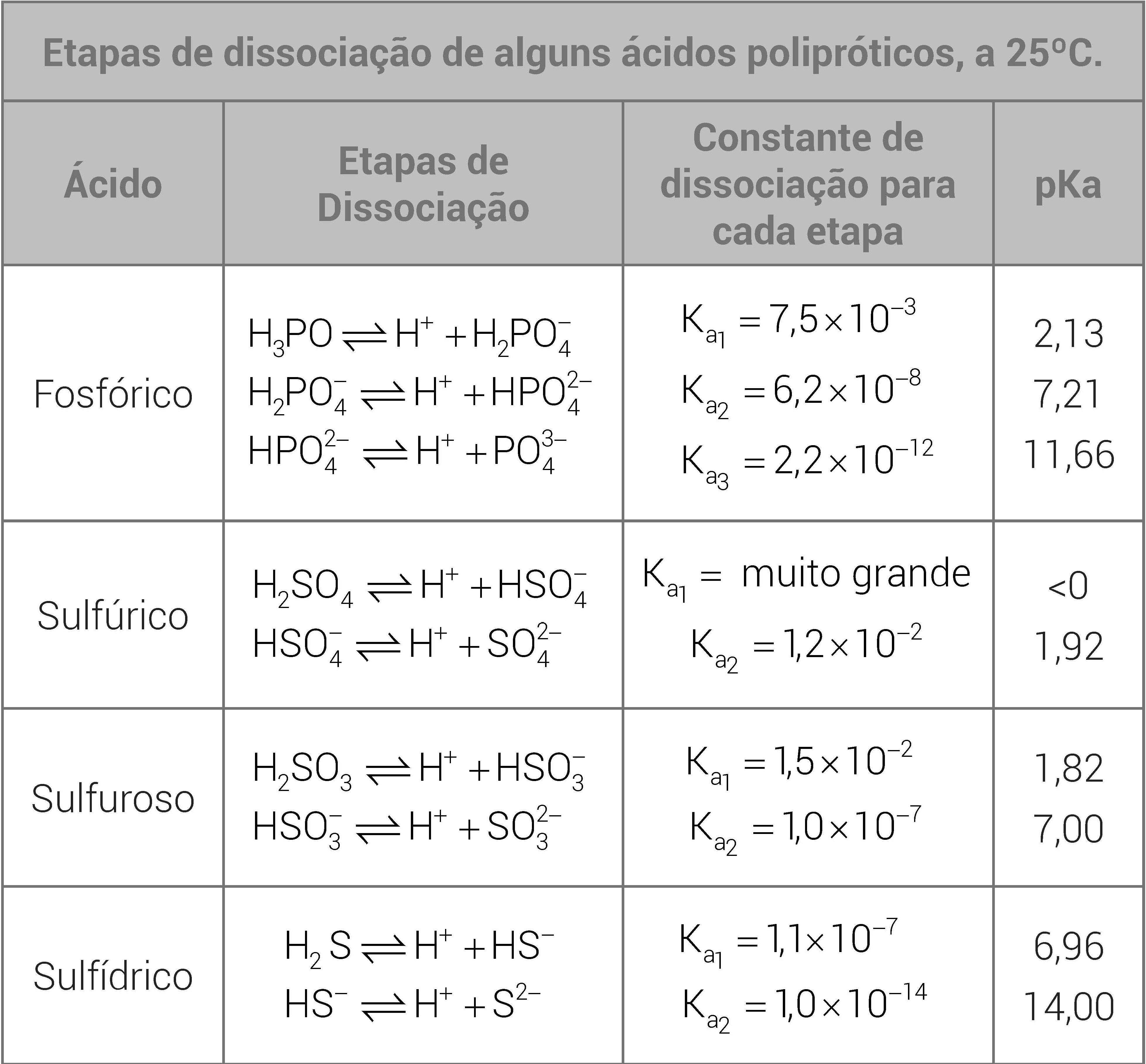
Acidez basicidad y equilibrio. El equilibrio ácido-base del agua. El grado de acidez de una disolución. Concepto de pH. A constante de ionização ou constante de dissociação pode ser definida como um valor que expressa a relação entre as concentrações dos eletrólitos dissociados em meio aquoso, ou mais precisamente aplicando a lei da ação das massas podemos afirmar que é o equilíbrio iônico em solução aquosa, de acordo com lei da ação
UERJ Química AULA 46 Equilíbrio iônico: Constantes de acidez e basicidade e teoria de Bronsted-Lowry Exames de Qualificação UERJ 2019 – Resolução das questões de química Pois bem, a chamada Lei da Diluição de Ostwald é uma generalização dessa tabela, resultando em duas fórmulas que nos ajudam a encontrar as constantes de acidez e basicidade de ácidos e bases com maior rapidez. Visto: 1968 Desde hace muchos años los químicos han clasificado las sustancias en ácidos o bases. Lavoisier pensaba que las sustancias ácidas debían su comportamiento a la presencia de oxígeno. Pero fue Humphry Davy en 1810, quien demostró que el elemento que tenían en común todos los ácidos es el hidrógeno. La primera teoría ácido-base fue
Esta primeira aula de Equilíbrio Iônico trata da auto-ionização da água, como calcular o pH de ácidos e bases fortes e as constantes de acidez e basicidade El equilibrio iónico es un equilibrio químico de disociación que se establece entre moléculas e iones en disoluciones poco disociantes, generalmente disolución acuosa. En estas disoluciones la mayor parte de las especies químicas que intervienen en la reacción se encuentran en estado iónico, formando cationes o aniones. Al tratarse de especies cargadas, estas disoluciones
1. O documento discute equilíbrio químico iônico, incluindo ácidos e bases, constante de equilíbrio, grau de ionização e lei de diluição. 2. É explicado que a autoionização da água produz íons hidrogênio e hidroxila, e que o pH e pOH são medidas desses íons. 3. O documento também aborda equilíbrios iônicos envolvendo soluções, como soluções tampão e equilíbrios de Equilíbrio Químico (revisão) Reacções ácido-base Definições de ácido e de base: Arrhenius, Brønsted e Lewis Constantes de acidez, Ka, e de basicidade, Kb Produto iónico da água, KW pH Força de ácidos e bases Antigamente, a determinação da acidez e basicidade das substâncias eram realizadas avaliando o sabor das amostras, visto que as substâncias ácidas são associadas ao sabor azedo e as básicas a um sabor adstringente. No entanto, determinar a característica ácida e/ou básica das substâncias por meio do sabor, não é nada interessante para o meio científico. Com isso,
Equilibrio Iónico: Teoría y Práctica Título del Capítulo Sistematización En este capítulo, aprenderás sobre el concepto de equilibrio iónico, incluyendo la constante de disociación ácida (Ka) y básica (Kb), el equilibrio de ácidos y bases débiles y el cálculo de pH en soluciones. También exploraremos las aplicaciones prácticas de estos conceptos en procesos industriales Configurações R e S. NOÇÕES DE ACIDEZ E BASICIDADE EM COMPOSTOS ORGÂNICOS: Conceitos fundamentais e caráter ácido-base dos compostos orgânicos. Fatores Que Influenciam a Acidez em Espécies Orgânicas. Constante Ácida e Básica (Ka e Kb). Relações Envolvendo pKa e pKb em Espécies Orgânicas. REAÇÕES ORGÂNICAS: Tipos de Cisão. 1) Introdução (00.15 ) 2) Apresentação do episódio (00.57 ) 3) O equilíbrio Iônico. (02.41) 4) Os diferentes nomes da constante de ionização (03.19) 5) O grau de Ionização (04.48 ) 5) A constante de acidez e basicidade (05.58) 6) A lei da diluição de Ostwald (08.40) 7) As informações da constante de ionização (10.21) 8) Encerramento (12.48) Convido todos vcs
Soluções de electrólitos. Equilibrio iónico
Intensivo UERJ Aula 46 – Constantes de acidez e basicidade e a teoria de Bronsted-LowryO tema da aula é equilíbrio iônico e nela vamos aprender sobre as Cons Está precisando praticar questões de UERJ sobre Sistemas Homogêneos: Equilíbrio Iônico: Conceitos, Diluição de Ostwald, Efeito do Íon Comum.? Aqui no Prisma você tem acesso gratuito a planejamento, aprendizado e prática para sua preparação do vestibular.
Saiba como calcular e determinar a força de um ácido ou de uma base a partir da análise e do cálculo de sua constante de ionização. pH representa o potencial hidrogeniônico e pOH é o potencial hidroxiliônico das soluções. Tratam-se de escalas logarítmicas utilizadas para medir o caráter ácido e básico de uma amostra. Os valores que as compõem variam de 0 a 14 e
Considerando uma equação química e sua correspondente constante de equilíbrio, pode-se afirmar corretamente que, multiplicando-se todos os seus coeficientes por 2, a constante de equilíbrio Acidez e Basicidade de Compostos Orgânicos Os conceitos de ácido e base, efeito de substituintes e catálise são fundamentos para toda a Química Orgânica.
- Grundstücke In Neuhausen/Enzkreis
- Er Schweigt Zu Kogler-Attacke : Was steckt hinter der türkisen Attacke gegen Vizekanzler Kogler?
- Environmental Health 1 – Community & Environmental Health: Grade 9 Module 1
- Episode 9 Staffel 2 Von Marvel’S Cloak
- Eppinger Mittagstisch , Eppinger Mittagstisch macht Sommerpause
- Erasmus In Portsmouth 2024-2025
- Epson Eh-Tw9200W 6 X 3D Brille
- Equity Factor Timing: A Two-Stage Machine Learning Approach
- Erdogans Feinde: Die Angst Der Türkischen Lgbtq-Community
- Erdbeerkuchen Mit Pudding Und Sahne Rezepte
- Erektionsstörungen Bei Vocado : Rezepte bei Potenzstörungen
- Erfahrungen Mit Kerscher Oder Eta Beta Felgen Im Toyota Supra Forum
- Epidemiologie Jobs – Epi Stellenbörse
- Erc3643: An Official Standard For Permissioned Tokens